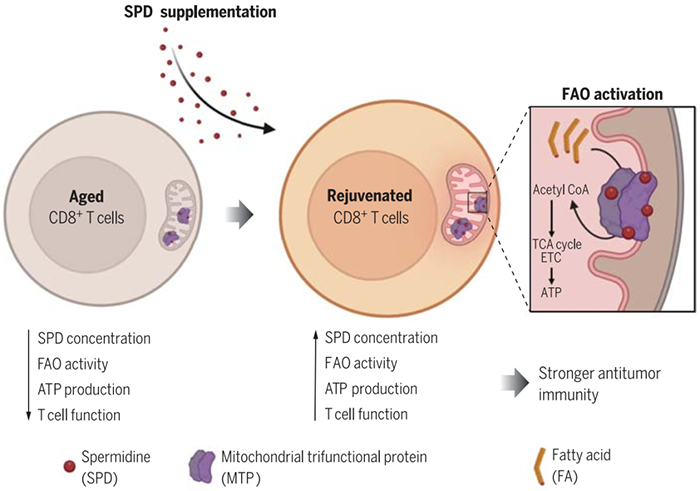
在哺乳动物中,免疫系统功能会随着年龄的增长而下降。这是由多种因素造成的,其中包括胸腺退化导致T细胞抗原库的输出和多样性下降、炎症引起细胞代谢的变化以及免疫细胞增殖分化以及维持的缺陷。老年人更容易遭受感染以及患上癌症,通常的治疗方法包括癌症免疫疗法PD-1/PD-L1抑制,但与年轻人相比PD-1/PD-L1抑制疗法在老年人体内通常效果不佳。在人体中存在一种生物多胺亚精胺(Spermidine)会随着年龄的增加而降低【1】,补充亚精胺可以改善或者延缓与衰老的相关的疾病【2】。那么亚精胺随衰老出现的缺乏与T细胞免疫抑制之间的关系是如何呢?为此,日本京都大学Tasuku Honjo研究组与Sidonia Fagarasan研究组合作在Science发文题为Spermidine activates mitochondrial trifunctional protein and improves antitumor immunity in mice,揭开了亚精胺通过激活线粒体三功能蛋白MTP促进抗肿瘤免疫的具体分子机制,为肿瘤免疫治疗提供了新的补充和可能性。首先,作者们验证了在衰老的小鼠中无论是总亚精胺还是游离的亚精胺浓度都显著降低,但其他种类的生物多胺并不会随着衰老表现出明显的变化。另外,作者们发现衰老小鼠始发态CD8+T细胞中亚精胺的浓度只有年轻小鼠中的一半。因此,作者们想知道亚精胺的缺乏是否是PD-L1在衰老小鼠中治疗无响应的原因。作者们发现,亚精胺的补充的确能够显著提高PD-L1在小鼠抗肿瘤中的反应,并大大延长衰老小鼠的寿命。但需要提出的是,亚精胺本身并不具有抗肿瘤的效果。有研究曾经报道T细胞线粒体活性与抗肿瘤能力相关【3-4】,作者们发现亚精胺处理会引起线粒体激活,在95个增加的蛋白中,35个蛋白与氧化磷酸化相关。因此,亚精胺能够提高PD-1免疫抑制治疗的效果,而这一过程是通过激活CD8+T细胞中线粒体代谢引起的。另外,作者们发现这一过程非常迅速,在处理CD8+T细胞后1小时即可以提高线粒体脂肪酸氧化代谢。进一步地,通过生物化学分析,作者们发现亚精胺与线粒体三功能蛋白MTP(Mitochondrial trifunctional protein)结合。MTP是脂肪酸氧化的中心酶,其中包括两个亚基HADHA以及HADHB,作者们发现这两个亚基都能够与亚精胺高亲和力结合,并通过变构增强其脂肪酸氧化酶的活性。作者们工作发现亚精胺衍生的另外一种多胺——精胺(Spermine)也能够直接与MTP结合并竞争性抑制亚精胺的脂肪酸氧化酶的活性,这说明亚精胺与精胺的平衡对与衰老细胞脂肪酸氧化非常关键。总的来说,作者们的工作发现亚精胺通过直接结合MTP增强脂肪酸的氧化(图1)。因此,补充亚精胺可以促进脂肪酸氧化的活性,增强CD8+T细胞线粒体的活性和功能。这一发现为抗肿瘤PD-1抑制治疗的无反应性提供了新的补充治疗方案以及策略。
原文链接:
https://doi.org/10.1126/science.abj3510
1. F. Madeo, T. Eisenberg, F. Pietrocola, G. Kroemer, Spermidine in health and disease. Science 359, eaan2788 (2018). doi: 10.1126/science.aan2788; pmid: 29371440
2. D. J. Puleston et al., Polyamine metabolism is a central determinant of helper T cell lineage fidelity. Cell 184, 4186–4202.e20 (2021). doi: 10.1016/j.cell.2021.06.007; pmid: 34216540
3. P. S. Chowdhury, K. Chamoto, A. Kumar, T. Honjo, PPAR-Induced Fatty Acid Oxidation in T Cells Increases the Number of TumorReactive CD8+ T Cells and Facilitates Anti–PD-1 Therapy. Cancer Immunol. Res. 6, 1375–1387 (2018). doi: 10.1158/2326-6066.CIR-18-0095; pmid: 30143538
4. K. Chamoto et al., Mitochondrial activation chemicals synergize with surface receptor PD-1 blockade for T cell-dependent antitumor activity. Proc. Natl. Acad. Sci. U.S.A. 114, E761–E770(2017). doi: 10.1073/pnas.1620433114; pmid: 28096382